
Allergan ruft Brustimplantate nach FDA Krebswarnung zurück
WASHINGTON, D.C. - Die U.S. Food and Drug Administration (FDA) hat den Pharmariesen Allergan aufgefordert, freiwillig einige ihrer Brustimplantate und Gewebeexpander vom Markt zu nehmen.

In einem Web-Post gab die Bundesbehörde heute bekannt, dass sie "bedeutende Maßnahmen zum Schutz von Frauen vor dem Brustimplantat-assoziierten anaplastischen Großzell-Lymphom (BIA-ALCL) ergriffen hat, indem sie forderte, dass Allergan, der Hersteller einer bestimmten Art von strukturiertem Implantat, bestimmte Modelle seiner strukturierten Brustimplantate auf dem US-Markt zurückruft, da das Risiko von BIA-ALCL besteht".
Die stellvertretende Vizepräsidentin der FDA, Amy Abernethy, erklärte, dass die Behörde Beweise habe, die darauf hindeuteten, dass "das Produkt eines bestimmten Herstellers in direktem Zusammenhang mit einem erheblichen Schaden für den Patienten, einschließlich des Todes, zu stehen schien", und dass die FDA Maßnahmen ergriffen habe, "um das Unternehmen auf neue Beweise aufmerksam zu machen, die darauf hindeuten, dass ein Rückruf zum Schutz der Gesundheit von Frauen gerechtfertigt sei".
Auf Anfrage der Behörde, gemäß der FDA-Ankündigung, hat Allergan der FDA mitgeteilt, dass "sie mit einem weltweiten Rückruf ihrer texturierten BIOCELL-Brustimplantatprodukte voranschreitet, einschließlich: Natrelle Saline-Filled Brustimplantate, Natrelle Silicon-Filled Brustimplantate, Natrelle Inspira Silicon-Filled Brustimplantate und Natrelle 410 Highly Cohesive Anatomically Shaped Silicon-Filled Brustimplantate."
Für weitere Informationen zu diesem Implantatrückruf, der die Gesundheit vieler erwachsener Künstler beeinträchtigen könnte, lesen Sie die vollständige FDA-Ankündigung hier.
Das könnte dich auch interessieren
... ausgewählte Beiträge aus der Sex- & Erotikwelt

Adult Time veröffentlicht neue Folge von 'MILF Overload'
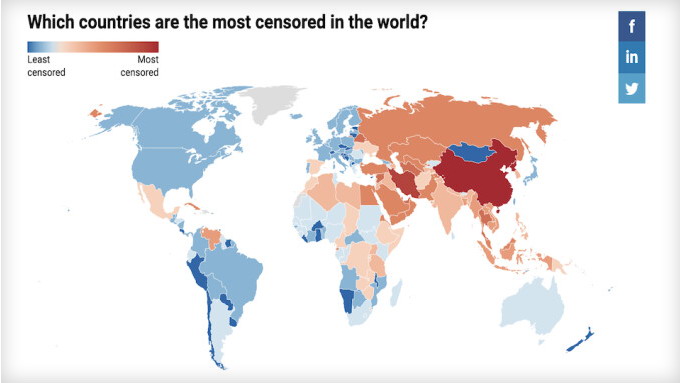
Neuer Bericht: Asien führt 'besorgniserregenden' globalen Trend zur Internetzensur an

Maggie MacDonalds neues Video erklärt das Geschäft mit den Plattformen für Erwachsene

Profil: Sara Gaffoor

AEBN gibt die beliebtesten Suchanfragen für Januar und Februar bekannt

Am Set: Stars treffen in "Brazzers House" Staffel 4 aufeinander

Merida Sat gibt ihr DPP-Debüt für Immoral Productions

Die Krankenversicherung für Prostituierte
Der Porno-Ausweis kommt! Ohne Altersverifikation kein Pornhub und Co.

Wie man den Online-Handel mit Verhaltensanalysen ankurbelt
Hol Dir jetzt Deinen kostenlosen Testzugang

Tantra zum Beruf
Jobs.updates
-
Die Rodgau-Ladies suchen Verstärkung | Nieder-Roden Rodgau
JobRubrik: Erotikjobs













































































































